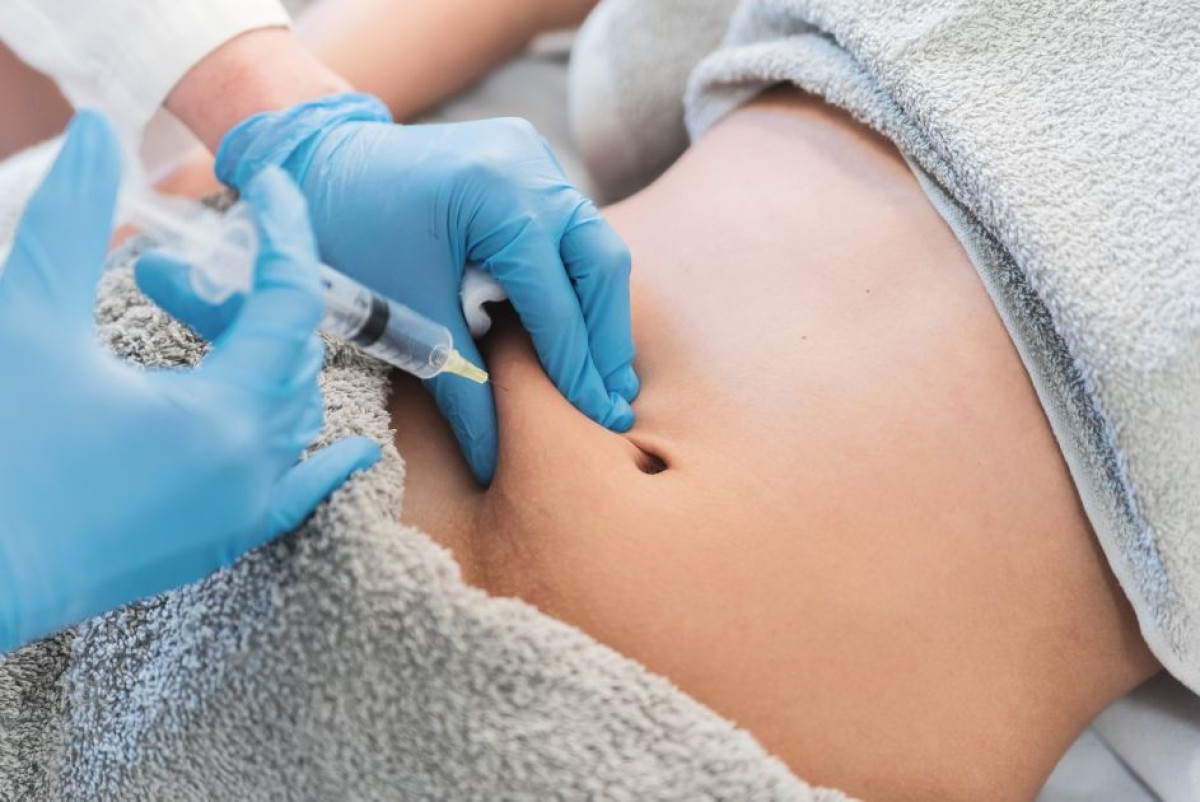
Μια νέα, επαναστατική φαρμακευτική ένεση για τη μείωση του λίπους στην κοιλιακή χώρα βρίσκεται πλέον ένα βήμα πριν από την τελική έγκριση από τον αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA). Το φάρμακο ονομάζεται CBL-514 και έχει αναπτυχθεί από την εταιρεία Caliway Pharmaceuticals με έδρα την Ταϊβάν. Πρόκειται για την πρώτη παγκοσμίως ένεση που μπορεί να προκαλέσει προγραμματισμένο κυτταρικό θάνατο σε λιποκύτταρα, στοχεύοντας συγκεκριμένες περιοχές του σώματος, όπως η κοιλιά ή οι μηροί.
Το CBL-514 είναι ένα μόριο μικρού μεγέθους που, μέσω υποδόριας ένεσης, επάγει την απόπτωση των λιποκυττάρων. Αντί να «λιμοκτονεί» το λίπος, το φάρμακο καταστρέφει τα λιποκύτταρα σε συγκεκριμένες περιοχές, οδηγώντας σε σημαντική μείωση του υποδόριου λίπους μέσα σε λίγες εβδομάδες και χωρίς χειρουργική επέμβαση. Αυτή τη στιγμή, το φάρμακο δοκιμάζεται για τρεις διαφορετικές χρήσεις: για μη χειρουργική μείωση του λίπους, για τη θεραπεία της σπάνιας νόσου Dercum (που προκαλεί επώδυνους λιπώδεις όγκους) και για την αντιμετώπιση της κυτταρίτιδας.
Η εταιρεία υποστηρίζει ότι το CBL-514 έχει δείξει εξαιρετική ασφάλεια και ανεκτικότητα κατά τις κλινικές δοκιμές, προσφέροντας αποτελέσματα συγκρίσιμα με εκείνα της λιποαναρρόφησης, χωρίς όμως να απαιτείται χειρουργείο. Αν και υπάρχουν αρκετές πιθανές εφαρμογές, ο βασικός στόχος αυτή τη στιγμή είναι η μείωση του κοιλιακού λίπους σε άτομα που επιθυμούν να απαλλαγούν από τοπικό πάχος με μη επεμβατικό τρόπο.
Το φάρμακο έχει ήδη ολοκληρώσει δύο επιτυχείς κλινικές μελέτες Φάσης 2b (CBL-0204 και CBL-0205) και ετοιμάζεται να περάσει στη Φάση 3, με παγκόσμιες κλινικές δοκιμές να ξεκινούν το δεύτερο εξάμηνο του 2025.
Στη μελέτη CBL-0205, που είναι η πιο πρόσφατη, το 75% των συμμετεχόντων παρουσίασε μείωση του κοιλιακού λίπους κατά τουλάχιστον έναν βαθμό στην ειδική κλίμακα αξιολόγησης AFRS, μόλις τέσσερις εβδομάδες μετά τη χορήγηση μιας και μόνο ένεσης. Το ποσοστό αυτό επέτρεψε στο CBL-514 να ικανοποιήσει τα κριτήρια αποτελεσματικότητας που απαιτεί ο FDA, τα οποία είχε ήδη καλύψει σε προγενέστερες δοκιμές αναφορικά με την ασφάλεια και την ανοχή του.
Σήμερα, το μόνο εγκεκριμένο φάρμακο για την τοπική μείωση λίπους είναι το ATX-101 (ένεση δεοξυχολικού οξέος), το οποίο χρησιμοποιείται για μικρές περιοχές αλλά ενέχει σημαντικούς κινδύνους, όπως νεκρώσεις δέρματος, έλκη, νευρικές βλάβες και λοιμώξεις. Αντιθέτως, το CBL-514 δεν έχει συνδεθεί με παρόμοιες παρενέργειες, ακόμη και όταν χρησιμοποιείται σε μεγαλύτερες περιοχές του σώματος και σε πολλαπλές δόσεις.
Στην τελευταία κλινική μελέτη, περισσότερο από το 75% των συμμετεχόντων πέτυχε τον επιθυμητό στόχο μείωσης λίπους με μία ή δύο ενέσεις, ενώ η μέση απώλεια λίπους ξεπέρασε το διπλάσιο αυτού του στόχου. Αυτά τα αποτελέσματα ήταν παρόμοια με εκείνα της πρώτης μελέτης Φάσης 2b, η οποία δημοσιεύθηκε τον Δεκέμβριο του 2024 και έδειξε ότι το 76,7% των 107 συμμετεχόντων παρουσίασε αισθητή βελτίωση με μία μόνο ένεση σε ποσοστό τριών τετάρτων.
Η Caliway υπογραμμίζει ότι το CBL-514 είναι το πρώτο στην κατηγορία του μικρομοριακό φάρμακο για λιπόλυση, που μπορεί να προκαλέσει απόπτωση και καταστροφή λιποκυττάρων χωρίς να επηρεάζει το κεντρικό νευρικό σύστημα, το καρδιαγγειακό ή το αναπνευστικό. Οι προκλινικές μελέτες έδειξαν ότι το φάρμακο ενεργοποιεί μοριακούς διαμεσολαβητές της απόπτωσης, όπως η κασπάση 3 και η αναλογία Bax/Bcl-2, προκαλώντας καταστροφή λιποκυττάρων τόσο σε εργαστηριακές όσο και σε ζωικές μελέτες.
Παρόλο που η πιο προφανής εφαρμογή είναι η αισθητική, δηλαδή η μη χειρουργική «γλυπτική» του σώματος, το CBL-514 φαίνεται να προσφέρει και ευρύτερα οφέλη. Το κοιλιακό λίπος, ιδίως στη μέση και τρίτη ηλικία, σχετίζεται με αυξημένο κίνδυνο για χρόνιο πόνο, εγκεφαλικά επεισόδια και καρδιοπάθειες. Αν και το φάρμακο δεν στοχεύει το εν τω βάθει σπλαχνικό λίπος, η μείωση του υποδόριου λίπους κατά περισσότερο από 25% φαίνεται να συμβάλλει έμμεσα και στη μείωση του κινδύνου αυτών των παθήσεων.
Το 2023, το CBL-514 έλαβε από τον FDA την έγκριση ως Investigational New Drug (IND), ενώ έναν χρόνο αργότερα εξασφάλισε και το καθεστώς Orphan Drug από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) για τη θεραπεία της νόσου Dercum.
Τον Μάιο του 2025, η εταιρεία έλαβε το «πράσινο φως» για να προχωρήσει στη Φάση 3. Οι δύο τελικές δοκιμές θα διεξαχθούν στις ΗΠΑ, τον Καναδά και την Αυστραλία, με περίπου 300 συμμετέχοντες σε σχεδόν 30 κλινικά κέντρα στη Βόρεια Αμερική.
Η Vivian Ling, CEO της Caliway, δήλωσε ότι
Είμαστε ικανοποιημένοι που επιτύχαμε συμφωνία με τον FDA τόσο για τον σχεδιασμό της μελέτης όσο και για την ένδειξη. Η έγκριση της ‘μείωσης του υποδόριου λίπους στην κοιλιακή χώρα’ ενισχύει την εμπιστοσύνη μας στη διαφοροποιημένη αξία του CBL-514 και στη δυνατότητά του να επαναπροσδιορίσει τα πρότυπα στην αισθητική ιατρική.
Εφόσον οι δοκιμές Φάσης 3 είναι επιτυχείς, το φάρμακο αναμένεται να κυκλοφορήσει στην αγορά μέσα σε διάστημα 12 μηνών.
[via]